Opracowanie i wdrożenie przemysłowe biotechnologicznej metody hydroksylacji witaminy D3 i jej pochodnych
Kalcyfediol – wszechstronny lek
Kalcyfediol, czyli 25-hydroksy-witamina D3, jest aktywną substancją leku Devisol25. Kalcyfediol jest niezbędnym składnikiem regulującym gospodarkę wapniowo-fosforanową u człowieka i charakteryzuje się wyższą aktywność niż witamina D3. Lek ten stosowany jest jako terapeutyk w przypadku schorzeń związanych z niedoborem witaminy D3, np. demineralizacją kości, niewydolnością wątroby, spowodowanym lekami zahamowaniem aktywności 25-hydroksylazy wątrobowej (przy stosowaniu leków przeciwdrgawkowych), niewydolnością nerek związaną z podwyższonym poziomem parathormonu, nerczycą, u pacjentów po transplantacjach czy w przypadku hipogonadyzmu u mężczyzn. Wysokie dawki kalcyfediolu wydają się również działać osłonowo w przypadku ciężkiego przebiegu zakażenia SARS-Cov-2, zmniejszając istotnie szansę hospitalizacji na oddziałach OIOM. Przeprowadzone niedawno badania kliniczne wykazały skuteczność tego leku w prewencji powikłań przy COVID-19 [1].
Obecnie kalcyfediol otrzymywany jest metodami chemicznymi (wieloetapowa synteza organiczna). Polską syntezę kalcyfediolu opracował w latach 80 Instytut Farmaceutyczny w Warszawie [2]. Ten wieloetapowy proces wymaga dużego nakładu pracy i czasu, charakteryzuje się niską wydajnością końcową (ok. 20%) oraz wymaga skomplikowanej procedury oczyszczania związku finalnego.
Nieoczekiwane odkrycie
W IKiFP PAN opracowano metodę syntezy kalcyfediolu z witaminy D3 (cholekalcyferolu) na drodze jednoetapowej reakcji regioselektywnej hydroksylacji. W procesie wykorzystywany jest preparat enzymatyczny jako katalizator oraz chemiczne reutleniacze. Sam proces syntezy jest prosty do przeprowadzenia i łatwy do przełożenia na dużą skalę. Produkcja biokatalizatora wymaga jednak bardziej zaawansowanych metod mikrobiologicznych (hodowla bakterii w dużej skali) oraz biotechnologicznych (separacja biokatalizatora). Niemniej dzięki zastosowaniu odseparowanego biokatalizatora w procesie syntezy uzyskuje się produkt o bardzo wysokiej czystości.
Enzymem, który umożliwia syntezę kalcyfediolu jest dehydrogenaza C25 steroidowa (S25DH), enzym pochodzący z bakterii Sterolibacterium denitrificans. Bakteria ta potrafi żywić się cholesterolem nawet w warunkach beztlenowych a ponieważ do utleniania tego związku nie wykorzystuje tlenu cząsteczkowego, posługuje się dość nietypowymi biokatalizatorami. Jednym z takich nietypowych enzymów jest S25DH. S25DH katalizuje reakcję hydroksylacji, czyli wprowadza grupę OH tylko i wyłącznie przy dwudziestym piątym atomie węgla, w obrębie bocznego łańcucha cholesterolu i jego pochodnych. Oznacza to, że katalizowana reakcja jest regioselektywna, czyli zachodzi tylko w jednym miejscu cząsteczki chemicznej. Nieoczekiwanie okazało się, że enzym jest w stanie hydroksylować nie tylko pochodne cholesterolu ale również witaminę D3. A wszystko zaczęło się od badań zupełnie podstawowych, próby odpowiedzenia na pytanie, jak działa dehydrogenaza C25 steroidowa?

Model homologiczny katalitycznej części enzymu S25DH oraz wnętrze jego centrum aktywnego zawierające kofaktor molibdenowy.
Badania podstawowe – początek drogi do wdrożenia
Przygoda naukowców z IKiFP PAN z dehydrogenazą C25 steroidową rozpoczęła się od badań teoretycznych, gdzie w grupie Biokataliza Teoretyczna i Eksperymentalna profesor Maciej Szaleniec prowadził badania enzymów molibdenowych. Właśnie takim enzymem jest S25DH i dlatego prof. Szaleniec został zaproszony do wspólnych badań przez mikrobiologów z Uniwersytetu we Freiburgu w Niemczech. Badania teoretyczne pozwoliły zrozumieć jak jest zbudowane “serce enzymu” czyli tzw. centrum aktywne, w którym zachodzi reakcja hydroksylacji i w jaki sposób enzym utlenia cząsteczkę mimo braku dostępu do tlenu cząsteczkowego [3]. Enzym okazał się tak interesujący, że prof. Szaleniec wraz z grupą doktorantów i młodych naukowców postanowił rozpocząć również badania eksperymentalne i poznać aktywność S25DH z różnymi substratami. Charakterystyka biochemiczna S25DH oraz badania w kierunku przemysłowego zastosowania biokatalizatora stały się tematem doktoratu dr Agnieszki Wojtkiewicz. Chociaż pierwsze doniesienia w literaturze wskazywały, że enzym był praktycznie nieaktywny z witaminą D3 po zoptymalizowaniu warunków reakcji przez dr Wojtkiewicz udało się taką hydroksylację skutecznie przeprowadzić. Co więcej okazało się, że enzym szybciej hydroksyluje witaminę D3 niż swój naturalny substrat [4].
Badania aplikacyjne i wdrożenia
Badania aplikacyjne zostały sfinansowane przez Narodowe Centrum Badań i Rozwoju w ramach projektu LIDER. Dzięki środkom z NCBiR naukowcy z IKiFP PAN opracowali metodę oczyszczania enzymu (łatwą do wdrożenia do przemysłu), zoptymalizowali postać katalizatora (tak aby był on trwały i tani), sprawdzili jakie inne cenne substancje chemiczne mogą być hydroksylowane przez enzym. Po zakończeniu projektu NCBiR, prof. Szaleniec i dr Wojtkiewicz kontynuowali pracę nad zastosowaniem S25DH w syntezie kalcyfediolu. Bardzo ważnym krokiem było zwiększenie skali syntezy, czyli przejście od niewielkich próbówek wykorzystywanych w laboratorium (o objętości od 0.5 do 2 ml) do reaktorów wykorzystywanych w przemysłowej syntezie wartościowych leków. Te badania prowadzono przy współpracy z Instytutem Farmaceutycznym w Warszawie, co pozwoliło przeprowadzić próbne syntezy na skalę 5 litrów. W kolejnych latach Instytut pozyskał partnera przemysłowego, który sfinansował badania wdrożeniowe. To pozwoliło na przetestowanie metody w jeszcze większej skali i sprawdzenie czy biotechnologiczna metoda syntezy jest konkurencyjna wobec stosowanej metody chemicznej. W ramach tego projektu zoptymalizowano hodowlę bakterii produkującej enzym. Hodowla taka przebiega w tzw. fermentorach w skali zbliżonej do przemysłowej (40-120 litrów). Opracowano też metodę przygotowania dużych ilości katalizatora (5-10 litrów). Ostatecznie badania wdrożeniowe zakończyły się sukcesem i IKiFP PAN sprzedał licencję partnerowi przemysłowemu.
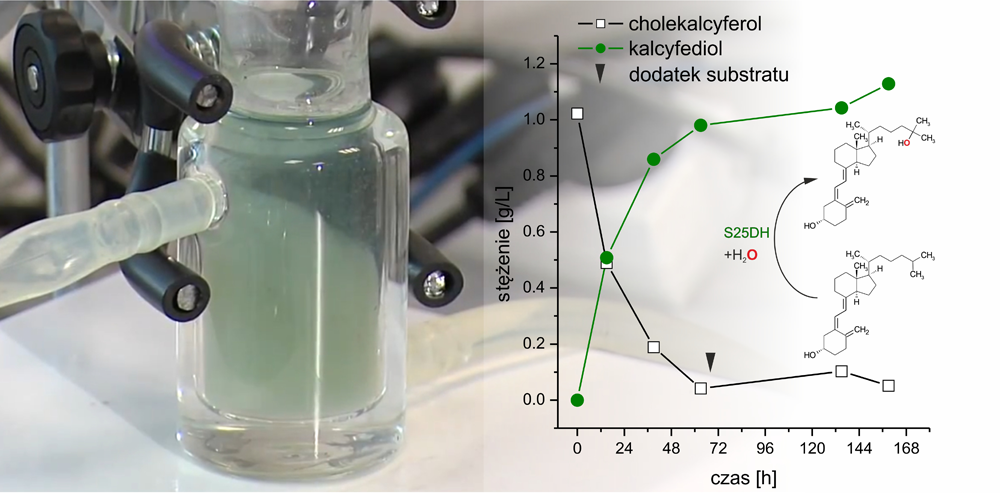
Hydroksylacja witaminy D3 do kalcyfediolu w reaktorze laboratoryjnym
I co dalej?
Oczywiście rodzi się pytanie, jaki jest dalszy ciąg tej historii? Pewne jej aspekty muszą być niestety nadal owiane tajemnicą i Instytut jeszcze nie może się z Państwem podzielić jej szczegółami. Przynajmniej, dopóki na aptecznych półkach nie zawita kalcyfediol wyprodukowany dzięki metodzie opracowanej w Instytucie. Proszę trzymać więc za nas kciuki. Nasi naukowcy cały czas pracują i wspierają partnerów przemysłowych by już wkrótce można było uruchomić biotechnologiczną produkcję generycznego leku.
Literatura
[1] M. Entrenas Castillo, L.M. Entrenas Costa, J.M. Vaquero Barrios, J.F. Alcalá Díaz, J. López Miranda, R. Bouillon, J.M. Quesada Gomez, “Effect of calcifediol treatment and best available therapy versus best available therapy on intensive care unit admission and mortality among patients hospitalized for COVID-19: A pilot randomized clinical study”, J. Steroid Biochem. Mol. Biol. 203 (2020) 105751.
[2] T. Ryznar, M. Krupa, A. Kutner, “Syntheses of vitamin D metabolites and analogs. Retrospect and prospects”, Przem. Chem. 81(5) (2002) 300-310.
[3] A. Rugor, A. Wójcik-Augustyn, E. Niedzialkowska, S. Mordalski, J. Staroń, A. Bojarski, M. Szaleniec, “Reaction mechanism of sterol hydroxylation by steroid C25 dehydrogenase – Homology model, reactivity and isoenzymatic diversity”, J. Inorg. Biochem. 173 (2017) 28–43
[4] A. Rugor, M. Szaleniec, J. Staroń, “Sposób otrzymywania 25-hydroksylowanej witaminy D3 (kalcyfediolu)”, Polish Patent PL 235932 (2020)