Biokataliza Teoretyczna i Eksperymentalna
Tematyka badawcza
Nasze badania skupiają się na enzymach oraz syntetycznych układach naśladujących te biokatalizatory. Wykorzystując metody teoretyczne i eksperymentalne staramy się wyjaśnić molekularne mechanizmy działania badanych układów oraz opracować użyteczne biokatalizatory.
GŁÓWNE KIERUNKI BADAŃ
- Badanie spektrum substratowego enzymów oraz chromatograficzna analiza produktów reakcji.
- Badania kinetyki i termodynamiki reakcji enzymatycznych.
- Badania inhibicji i dezaktywacji enzymów.
- Badania nad immobilizacją enzymów.
- Badania nad optymalnym systemem reaktorowym i układem do ekstrakcji produktów reakcji.
- Modelowanie struktur kompleksów enzym-substrat metodami dokowania oraz dynamiki molekularnej.
- Modelowanie reaktywności enzymów metodami analizy korelacyjnej (QSAR).
- Modelowanie enzymów, w tym ich ścieżek reakcji, metodami chemii kwantowej (QM i QM/MM).
- Krystalizacja i rozwiązywanie struktur przestrzennych enzymów.
- Badania nad bakteryjną produkcją polihydroksyalkanianów (PHA).
- Badania funkcjonalizacji polimerów PHA wybranymi lekami z grupy antybiotyków, sterydów i niesteroidowych leków przeciwzapalnych na drodze biokatalizy.
- Badania estryfikacji cukrów monomerami PHA – (R)-3-hydroksykwasami.
- Badania nowych antybiotyków na bazie (R)-3-hydroksykwasów.
- Badania nowych cieczy głęboko eutektycznych na bazie monomerów PHA.
METODY
- Badania kinetyki enzymatycznej w stanie stacjonarnym i przed-stacjonarnym z zastosowaniem testów aktywności opartych o techniki spektroskopowe i chromatograficzne.
- Wyznaczanie kinetycznych efektów izotopowych z wykorzystaniem technik spektroskopowych, chromatograficznych i teoretycznych.
- Zastosowanie FPLC i technik elektroforetycznych do oczyszczania i monitorowania czystości enzymów.
- Zastosowanie wysokosprawnej chromatografii cieczowej z detektorami DAD i MS/MS (LC-DAD-ESI/APCI-MS) i gazowej GC-MS do separacji i identyfikacji produktów reakcji enzymatycznych.
- Zastosowanie ekstrakcji ciecz-ciecz i ciecz-ciało stałe (SPE) do otrzymywania produktów reakcji.
- Izotermiczna kalorymetria titracyjna (ITC) jako metoda badania termodynamiki reakcji enzymatycznej.
- Modelowanie struktur enzymów i przebiegu reakcji enzymatycznych z zastosowaniem metod teoretycznych (modelowanie homologiczne, symulacje MD, obliczenia QM, QM/MM i QM/MM MD).
- Symulacje dynamiki molekularnej oraz dokowania molekularnego dla kompleksów enzym-substrat.
- Zastosowanie metodologii QSAR i sztucznych sieci neuronowych do modelowania kinetyki enzymatycznej w oparciu o parametry kwantowo-mechaniczne.
- Badania strukturalne białek metodami rentgenograficznymi oraz cryo-EM.
- Prowadzenie fermentacji mikrobiologicznej w kolbach oraz fermentorach.
- Opracowywanie procedur skalowania procesów fermentacyjnych w górę i w dół.
GŁÓWNE OSIĄGNIĘCIA
- Uzyskanie wglądu w przebieg reakcji enzymatycznych szeregu metaloenzymów.
- Wyznaczenie nowych struktur przestrzennych dla badanych enzymów, w tym ich kompleksów z substratami.
- Opracowanie metod przemysłowej syntezy enzymatycznej szeregu związków biologiczne aktywnych i leków.
- Wdrożenie biotechnologicznej metody syntezy kalcifediolu.
- Opracowanie ścieżek syntezy modyfikowanych PHA na drodze chemicznej katalizy i biokatalizy.
- Opracowanie ścieżek syntezy małocząsteczkowych związków bioaktywnych na bazie monomerów PHA (estry cukrowe, antybiotyki, ciecze głęboko eutektyczne).
- Zaprojektowanie i realizacja funkcjonalnego modułu biorafinerii biomasy do pozyskiwania biopolimerów.
BADANE UKŁADY – WYBÓR
Enzymy molibdenowe
Dehydrogenaza etylobenzenowa (EBDH) jest jednym z przedstawicieli molibdenowych enzymów badanych w grupie Biokataliza Teoretyczna i Eksperymentalna. EBDH jest bakteryjnym enzymem z należącym rodziny reduktaz DMSO. EBDH jest pierwszym, kluczowym enzymem w beztlenowym szlaku mineralizacji etylobenzenu, który umożliwia wzrost bakterii na pożywce bogatej w etylobenzen i azotany w środowisku beztlenowym.
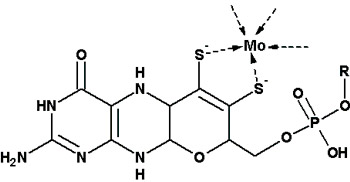
Enzymy molibdenowe posiadają centrum aktywne zawierające pojedynczy atom molibdenu, jeden lub dwa kofaktory pterydynowe oraz dodatkowe ligandy – najczęściej resztę aminokwasową (Ser, Cys, SeCys, Asp), oraz zazwyczaj ligand tlenowy Mo=O.
|
kofaktor molibdenowy |
struktura EBDH |
EBDH jest złożonym enzymem bakteryjnym (αβγ 164 kDa) zawierającym centrum monomolibdenowe (MoCo), klastery żelazo-siarkowe oraz grupę hemową typu b559. EBDH katalizuje stereospecyficzną reakcję hydroksylacji etylobenzenu do 1-(S)-fenyloetanolu.
HppE
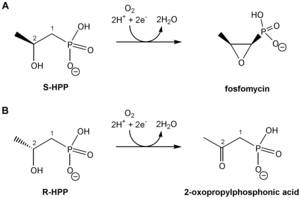
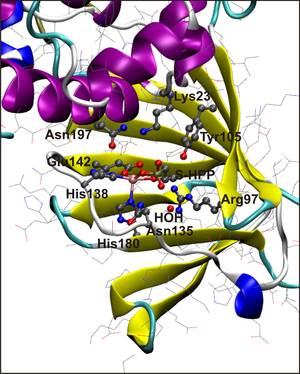
Epoksydaza kwasu (S)-2-hydroxypropylfosfonowego (HppE) jest bakteryjnym enzymem katalizującym ostatni etap biosyntezy fosfomycyny – antybiotyku stosowanego w praktyce klinicznej. HppE należy do niehemowych enzymów żelazowych, co oznacza, że w swoim miejscu aktywnym wiąże jon żelaza bez udziału grupy porfirynowej. Dla natywnego substratu – S-HPP, katalizowana reakcja polega na utleniającym odwodornieniu substratu z jednoczesnym utworzeniem pierścienia epoksydowego. Stereoizomer R-HPP ulega prostszemu utlenieniu do ketonu. Prowadzone badania mają na celu wyjaśnienie mechanizmu reakcji enzymatycznej HppE.
|
Reakcje katalizowane przez HppE |
Struktura miejsca aktywnego HppE |
Polihydroksyalkaniany
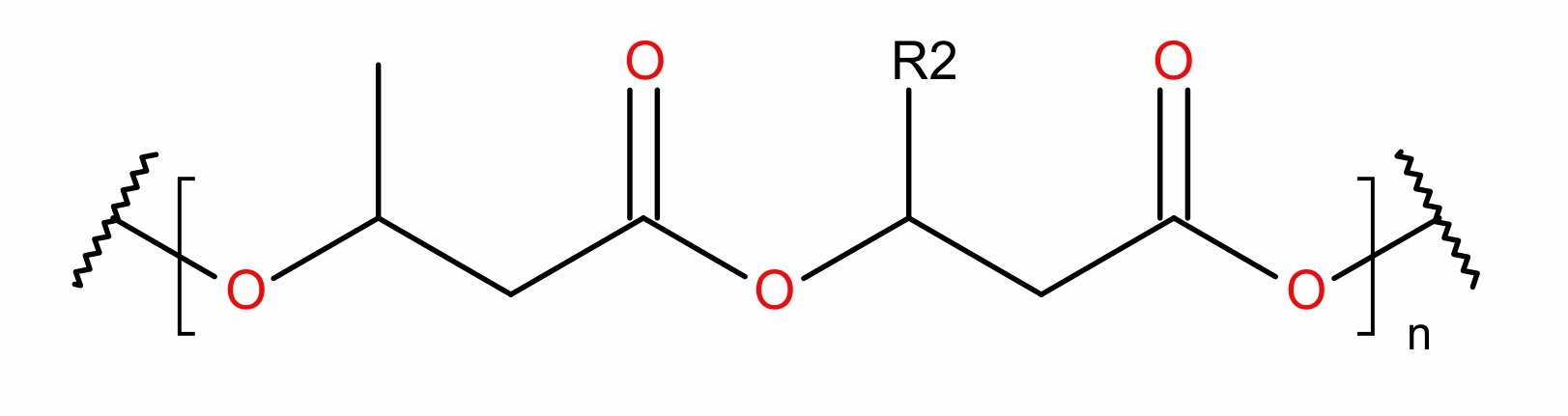
Polihydroksyalkaniany (PHA) to biopolimery, które reprezentują jeden z wiodących sektorów bioproduktów. PHA reprezentują klasę aktywnych optycznie biodegradowalnych poliestrów akumulowanych przez liczne bakterie jako wyodrębnione granulki wewnątrzkomórkowe bądź, jako pozakomórkowe struktury przypominające sieci. PHA służą przede wszystkim, jako rezerwa węgla i energii . Strukturę chemiczną PHA można opisać jako liniową formację (R)-3-hydroksykwasów, gdzie grupa karboksylowa jednego monomeru tworzy wiązanie estrowe z grupą hydroksylową sąsiadującego monomeru. PHA można podzielić na kilka kategorii w zależności od przyjętego kryterium. Biorąc pod uwagę wielkość monomeru PHA dzieli się na krótkie (C3–C5; scl-PHA), średnie (C6–C14; mcl-PHA) bądź długie (>C14; lcl-PHA) łańcuchowo polimery.
Nasze badania skupiają się na polimerach PHA jak i na ich monomerach. Prowadzone prace angażują biokatalizę w celu funkcjonalizacji polimerów PHA i jego monomerów. Wykorzystujemy enzymy z grupy α/β-hydrolaz – lipazy, dzięki którym tworzymy nowe materiały na bazie PHA. Bioplastik poddawany jest enzymatycznej funkcjonalizacji wybranymi lekami, z drugiej zaś strony monomery na drodze biokatalizy dołączane są do cząsteczek cukrów. Badania mają na celu stworzenie nowych materiałów do regenracji tkanek, materiałów opatrunkowych, nowych leków o działaniu antynowotworowym czy środków powierzchniowo czynnych.
W danej tematyce prowadzone są cztery projekty badawcze:
- Projekt Sonata NCN „Biosynteza nowych estrów laktozy za pośrednictwem lipaz. Charakterystyka ich właściwości fizykochemicznych i przeciwrakowych.” Nr 2015/17/D/ST4/0051
- Projekt Know “Biokatalityczna synteza estrów cukrowych”
- Projekt Lider NCBiR “Nowe sfunkcjonalizowane biopolimery do zastosowań medycznych” nr 0090/L-7/2015
- Projekt TECHMATSTRATEG „Technologia biorafinacji olejów roślinnych do wytwarzania zaawansowanych materiałów kompozytowych”nr 407507/1 / NCBR / 2019