Bakteriofagi – dobroczynne wirusy
Agnieszka Gibała 1,3, Joanna Szaleniec 2, Maciej Szaleniec 1*
1 Instytut Katalizy i Fizykochemii Powierzchni im. Jerzego Habera Polskiej Akademii Nauk, ul. Niezapominajek 8, 30-239 Kraków
2 Katedra i Klinika Otolaryngologii, Uniwersytet Jagielloński Collegium Medicum, Śniadeckich 2, 31-531 Kraków
3 Zakład Mikrobiologii Klinicznej Uniwersyteckiego Szpitala Dziecięcego w Krakowie, Wielicka 265, 30-663 Kraków
* email: maciej.szaleniec@ikifp.edu.pl
Streszczenie:
Bakteriofagi czyli “zjadacze bakterii” (z dosłownego tłumaczenia greckich słów phagein i baktērion) to wirusy, które atakują komórki bakteryjne, aby następnie się w nich replikować, a docelowo je niszczyć. Rosnąca liczba gatunków bakterii opornych na większość antybiotyków powoduje rosnące zainteresowanie wykorzystaniem bakteriofagów wleczeniu zakażeń bakteryjnych. W świecie, w którym antybiotyki stanowią standardową terapię pierwszego rzutu przeciwko infekcjom bakteryjnym, co pociąga za sobą lawinowo narastającą oporność bakterii i pojawianie się coraz to nowych, opornych szczepów, terapia fagowa wydaje się być nie tylko alternatywnym, ale być może i ostatecznym narzędziem obrony przed bakteriami. A zatem przewidywane zastosowanie fagów koncentruje się na trzech głównych wskazaniach: a) zwalczanie zakażeń z udziałem bakterii opornych na antybiotyki; b) zwalczanie zakażeń, które nie odpowiadają na leczenie antybiotykami oraz c) zwalczanie bakterii w okolicznościach, w których antybiotyki są przeciwwskazane z powodu alergii pacjenta lub problemów żołądkowo-jelitowych. Wysoki potencjał fagów w eliminowaniu bakterii może być wykorzystywany nie tylko w medycynie, ale także w przemyśle żywnościowym czy rolnictwie.
Wstęp
Bakteriofagi zostały odkryte na przełomie XIX i XX wieku. W roku 1896 Ernest Hankin jako pierwszy zaobserwował antybakteryjne właściwości wód Gangesu. Niecałe dwie dekady później, w roku 1915, brytyjski bakteriolog Frederick Twort wysunął hipotezę, że owym czynnikiem antybakteryjnym może być wirus. Jednak dopiero Félix d’Hérelle w roku 1917 jako pierwszy wyizolował fagi i użył ich do leczenia czerwonki bakteryjnej u dzieci [33]. To on również nadał im nazwę na podstawie ich właściwości, które obserwował. Bakteriofagi od początku stały się obiektem zainteresowania naukowców jako potencjalne narzędzie do leczenia wywoływanych przez bakterie chorób zakaźnych. Były wykorzystywane w terapii już w latach trzydziestych i czterdziestych XX wieku, przegrały jednak po II wojnie światowej konkurencję z antybiotykami. Jedynie w Związku Radzieckim i Europie Wschodniej badania nad fagoterapią były kontynuowane. Dopiero powszechne nadużywanie antybiotyków i związane z nim zjawisko narastania antybiotykooporności niebezpiecznych szczepów zakaźnych ponownie zwróciło uwagę krajów zachodnich w kierunku bakteriofagów.
Budowa bakteriofagów
Bakteriofagi zbudowane są z materiału genetycznego(DNA lub rzadziej RNA), który jest otoczony białkami strukturalnymi, tworzącymi tzw. kapsyd [33]. W materiale genetycznym zapisane są wszystkie informacje potrzebne do replikacji wirusa w komórce bakteryjnej, tzn. syntezy białek kapsydu oraz wszystkich enzymów pozwalających na powielenie materiału genetycznego, jego zapakowanie w kapsyd, wydostanie się wirusa na zewnątrz komórki i ponowne zainfekowanie nowej bakterii.

Ryc. 1a. Schemat budowy bakteriofagów [19] – struktura helikalna (pałeczkowata). Zreprodukowane za zgodą SIB Swiss Institute of Bioinformatics z serwisu ViralZone (https://viralzone.expasy.org/).

Ryc. 1b. Schemat budowy bakteriofagów [19] – struktura helikalna (pałeczkowata). Zreprodukowane za zgodą SIB Swiss Institute of Bioinformatics z serwisu ViralZone (https://viralzone.expasy.org/).

Ryc. 1c. Schemat budowy bakteriofagów [19] – struktura złożona.
Otoczka białkowa pełni rolę ochronną dla materiału genetycznego i jest odporna na czynniki zewnętrzne. Kapsyd może mieć różne kształty: helikalny (pałeczkowaty), izometryczny lub złożony (Ryc.1), czyli taki, który łączy obie formy. Helikalna otoczka zbudowana jest z podjednostek białkowych ułożonych spiralnie. Składa się ona z jednego głównego białka kapsydu i czterech innych białek, zlokalizowanych na jego końcach. Przykłady fagów mających kapsyd helikalny możemy znaleźć wśród przedstawicieli bakteriofagów z rodziny Inoviridae. Z kolei kapsyd bakteriofagów o strukturze izometrycznej zbudowany jest z podjednostek białkowych (kapsomerów), tworzących strukturę quasi-sferyczną. Przykłady kapsydów o takiej budowie można napotkać wśród wirusów z rodziny Microviridae. Struktura taka zbudowana jest z dwudziestu pięciobocznych pentamerów(zbudowanych z pięciu białek), które po złożeniu wszystkich 60 identycznych elementów dająw przybliżeniu kulistą formę o średnicy około 30 nm. U innych fagów kapsydy izometryczne mogą być jeszcze bardziej złożone i składać się z większej ilości białek tworzących struktury quasi-sferyczne. Natomiast kapsyd bakteriofagów o złożonej strukturze zbudowany jest z wielościennej główki i ogonka (Ryc. 1d) [19]. Głowa zbudowana z jednego lub kilku typów białek często przyjmuje quasi-sferyczne kształty. W dolnej części główki kapsyd przechodzi w ogonek. Jest on połączony z główką białkiem łącznikowym. Ogonek składa się z wewnętrznej tabularnej struktury rdzeniowej, otoczonej kurczliwą, helikalną pochewką. Zadaniem tej struktury jest transfer materiału genetycznego z bakteriofaga do komórki bakteryjnej. Ogonek zakończony jest płytką podstawową, w którą zazwyczaj wbudowane są białka pełniące kilka istotnych funkcji. Należą do nich enzymy (hydrolazy i liazy polisacharydowe), których zadaniem jest rozkładanie ściany komórkowej bakterii, a także białka umożliwiające rozpoznanie specyficznych receptorów na powierzchni bakterii i trwałe związanie się z ich powierzchnią. Ponadto, u niektórych fagów zaobserwowano obecność dodatkowej lipoproteinowej osłonki [33].
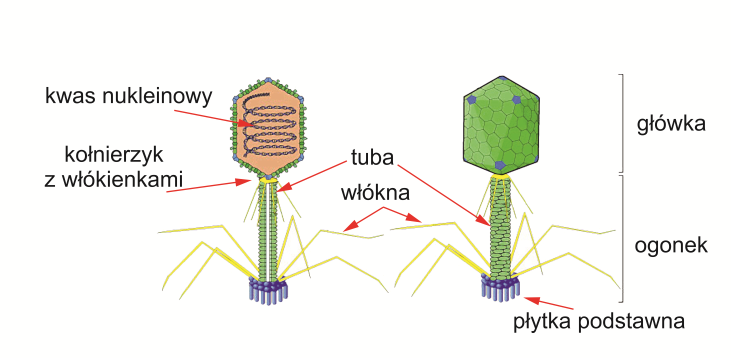
Ryc. 1d. Schemat budowy bakteriofagów [19] – ikozaedralna struktura białkowego kapsydu faga 80a atakującego Staphylococcus aureus (kod PDB 6C21) uzyskana metodą cryo-EM; pełen wirus posiada jeszcze cylindryczny ogonek [17]. Zreprodukowane za zgodą SIB Swiss Institute of Bioinformatics z serwisu ViralZone (https://viralzone.expasy.org/).

Ryc. 1e. Schemat budowy bakteriofagów [19] – kompleks kapsydu (kolorowe wstęgi) bakteriofagaMS2 z RNA (białe wstążki) (PDB 1aq3) [32].
Cykle replikacyjne bakteriofagów
Bakteriofagi charakteryzują się wysoką specyficznością. Oznacza to, że zwykle jeden gatunek wirusa może namnażać się tylko w jednym gatunku bakterii lub jedynie w obrębie konkretnego ich szczepu.
Pierwszym etapem infekcji fagowej jest proces odwracalnej adsorpcji bakteriofaga do komórki bakteryjnej. W procesie tym ważną rolę odgrywa płytka podstawowa oraz włókienka bakteriofaga, które rozpoznają specyficzne receptory na powierzchni komórki bakteryjnej. Receptorami tymi mogą być praktycznie wszystkie struktury powierzchniowe występujące u bakterii takie jak lipopolisacharydy, kwasy tejchojowe, białka, a nawet pilii wici bakterii. Ponieważ budowa ściany komórkowej bakterii Gram-ujemnych różni się diametralnie od ściany komórkowej bakterii Gram-dodatnich, i to zarówno pod względem strukturalnym, jak i składu chemicznego, bakteriofagi z reguły są zdolne atakować tylko jeden z tych podtypów bakterii. Kiedy u bakterii Gram-ujemnych częstym receptorem mogą być główne i boczne łańcuchy lipopolisacharydów i białka błonowe (np. kanały transportowe) [19] to już u bakterii Gram-dodatnich najczęstszym receptorem będą łańcuchy peptydoglikanu i kwasy tejchojowe (np. PGP (poli-[fosforan glicerolu]) i GTA (poli-[fosforan glukozo-N-acetylogalaktozaminy]). Drugorzędnymi receptorami potrafią być białka zakotwiczone w peptydoglikanie lub posiadające domenę penetrującą jego warstwę (np. transmembranowe białko OmpA). Jak wspomniano już wyżej bakteriofagi potrafią też rozpoznawać wici bakterii. Badania wykazały, że proces adsorpcji na wici jest odwracalny, dzięki czemu fagi stopniowo mogą dyfuzyjnie przemieszczać się w kierunku podstawy wici by tam przyczepić się do ściany komórkowej. Znane są również fagi (np. fAcM4 i fAcS2infekujące Asticcacaulis biprosthecum), które do wici przyczepiają się za pomocą specjalnego białka na styku główki i ogona (dzięki czemu ogonek jest wolny i gotowy do przyczepienia się do powierzchni bakterii) i co ciekawe zdolne są do przemieszczania wzdłuż wici w kierunku powierzchni komórki[23]. Dzięki tej różnorodności mechanizmów rozpoznawania bakterii oraz różnorodności samych powierzchniowych antygenów bakteryjnych w obrębie nawet tego samego gatunku bakterii, fagi bardzo często charakteryzują się niespotykaną specyficznością względem konkretnych szczepów[24].
Ponieważ bakteriofagi nie posiadają struktur umożliwiających czynny ruch, proces adsorpcji jest wynikiem przypadku i jest zależny od dyfuzji faga w środowisku bytowania bakterii. Tak więc prawdopodobieństwo związania faga z komórką gospodarza rośnie wraz ze wzrostem liczby fagów, jak i bakterii. Kiedy dojdzie już do związania receptora bakteryjnego z włókienkiem faga, osłonka bakteriofaga oddziałuje z receptorami na powierzchni bakterii, wiążąc się z nimi nieodwracalnie. Od tego momentu fag nie może opuścić powierzchni gospodarza, nawet jeżeli komórka bakteryjna jest uszkodzona lub martwa.
Proces integracji faga z komórką gospodarza często jest wspomagany przez wyspecjalizowane enzymy fagowe, tzw. depolimerazy polisacharydowe, katalizujące hydrolizę polisacharydowych osłonek bakterii lub egzopolisacharydowych polimerów tworzących bakteryjny biofilm. Enzymy te mogą być zlokalizowane zarówno na płytce podstawnej faga lub na jego ogonku i dzięki nim fagi łatwiej penetrują strukturę biofilmu oraz pokonują lipopolisacharydową warstwę ściany komórkowej bakterii (np. liaza alginianu z faga PT-6 umożliwiająca mu penetrację osłonki P. aeruginosa).
W dalszym etapie do wnętrza bakterii wprowadzany jest fagowy materiał genetyczny poprzez ogonek bakteriofaga. Po wstrzyknięciu materiału genetycznego do wnętrza bakterii pozostałe elementy faga (białka kapsydu) zostają na zewnątrz komórki gospodarza[26].
Odwołując się do sposobu, w jaki przebiega infekcja, bakteriofagi możemy podzielić na dwie grupy. Mówimy zatem o fagach wirulentnych, które prowadzą cykl replikacji litycznej oraz bakteriofagach zwyczajowo zwanych łagodnymi (niezjadliwymi),prowadzących replikację lizygeniczną [26].
Cykl replikacji lizogenicznej polega na tym, że po dostaniu się do komórki bakterii materiał genetyczny bakteriofaga pozostaje w niej niejako w stanie “uśpionym”. Kiedy bakteria ulega podziałom, genom faga jest kopiowany do komórek potomnych podobnie jak własny chromosom bakterii. Materiał genetyczny faga znajdujący się wewnątrz bakterii nosi nazwę profaga. Większość bakteriofagów łagodnych (np. fag λ) infekuje komórki bakteryjne przez integrację DNA do chromosomu. Mniej liczne (np. fag P1) mogą egzystować w komórkach w postaci plazmidu, tj. osobnego fragmentu DNA niezależnego od podstawowego materiału genetycznego bakterii.
Lizogenia może trwać przez wiele generacji – do czasu, gdy jakiś zewnętrzny bodziec (np. promieniowanie UV czy antybiotyki) zapoczątkuje cykl lityczny, który przebiega podobnie jak u fagów obligatoryjnie wirulentnych. W cyklu litycznym następuje produkcja nowych wirionów w komórce, a następnie ich uwolnienie poprzez rozpad (lizę) zainfekowanej komórki. Liza komórek bakteryjnych możliwa jest dzięki produkcji wirusowych enzymów litycznych (tzw. endolizyn), które rozcinają peptoglikan budujący ścianę komórkową bakterii oraz tzw. holin, czyli specjalnych białek wytwarzających tunele w błonie cytoplazmatycznej bakterii. Dzięki holinom endolizyny są w stanie dotrzeć do znajdującego się po drugiej stornie błony cytoplazmatycznej peptoglikanu[5]. Co ciekawe, cykl lityczny rozpoczyna się często w sytuacji, gdy pojawiają się sygnały mogące świadczyć o zagrożeniu dla komórki gospodarza. Powoduje to, że bardziej „opłacalne” staje się wyprodukowanie nowych wirionów i poszukiwanie innych gospodarzy, niż dalsza replikacja wraz z aktualnie zakażoną komórką. Co więcej, niedawne odkrycia wykazały, że fagi są w stanie porozumiewać się ze sobą za pomocą krótkich peptydów, które wpływają na ich „decyzję”, czy po infekcji mają replikować się wg cyklu litycznego, czy tez przejść w stan lizogeniczny [12]. Cykle rozwojowe fagów przedstawiono na Ryc.2.
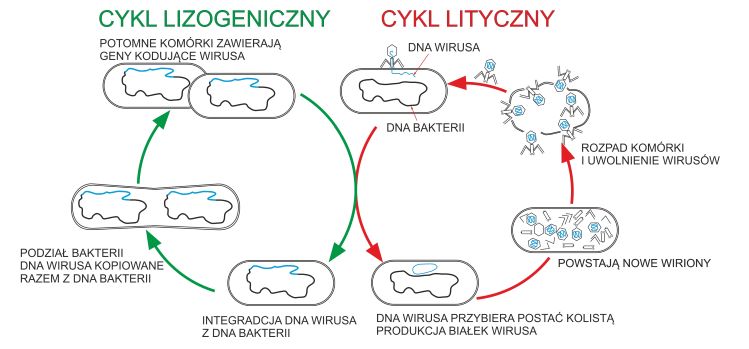
Ryc. 2. Schemat infekcji komórki bakteryjnej przez bakteriofaga. Rycina przygotowana na podstawie m.in. rysunku z blogaatlasbiologiczny.blogspot.com/2017/04/wirusy.html
Zastosowanie bakteriofagów w terapii (fagoterapia)
W ostatnich latach obserwujemy dwa niepokojące trendy dotyczące zwalczania zakażeń bakteryjnych. Po pierwsze opracowanie nowych antybiotyków wymaga coraz większych nakładów finansowych i jest generalnie coraz trudniejsze. Przyczyny tego zjawiska są bardzo złożone i wykraczające poza temat tego artykułu, ale w uproszczeniu można powiedzieć, że wszystkie łatwo dostępne źródła substancji bakteriobójczych zostały już przez przemysł farmaceutyczny dobrze wyeksplorowane i wszystkie łatwiejsze do znalezienia antybiotyki są przez nas obecnie używane. Na szczęście ostatnio nowe grupy związków zostały odkryte oraz stare antybiotyki w sposób kreatywny zostały zmodyfikowane, dzięki czemu ten niekorzystny trend może zostać odwrócony [7, 15, 22]. Drugim znacznie poważniejszym problemem jest wzrost oporności bakterii na powszechnie stosowane antybiotyki, który jest spowodowany zdolnością bakterii do ewolucyjnego przystosowania się do środowiska. Masowość stosowania antybiotykoterapii wprowadziła silną presję ewolucyjną na bakterie i wymusiła upowszechnienie się mechanizmów unieczynniających stosowane antybiotyki. Wynikająca z tych dwóch faktów coraz mniejsza skuteczność w walce z zakażeniami bakteryjnymi, wymusiła szukanie alternatywnych terapii przeciwbakteryjnych. Rozwój terapii fagowej wydaje się konieczny w obliczu nabywania oporności przez zjadliwe szczepy bakterii chorobotwórczych. Terapia fagowa uwzględnia celowaną aplikację bakteriofagów, które są zdolne do infekowania konkretnych szczepów bakteriii ich niszczenia. Do celów terapii fagowej stosowane są wyłącznie fagi lityczne, gdyż tylko takie fagi efektywnie niszczą bakterie.
W porównaniu z antybiotykami, bakteriofagi charakteryzują się wysoką specyficznością. Ponieważ atakują tylko konkretny szczep bakterii, nie niszczą przy tym naturalnej mikrobioty (np. flory jelitowej), dzięki czemu pozbawione są typowych dla antybiotyków działań niepożądanych, takich jak zaburzenia żołądkowo-jelitowe. Z drugiej strony, ze względu na wysoką specyficzność fagów przed rozpoczęciem terapii kluczowe jest dokładne zidentyfikowanie czynnika wywołującego zakażenie bakteryjne u danego pacjenta, tak aby wybrać bakteriofaga specyficznego dla danego szczepu bakterii. Proces doboru faga nazywa się typowaniem fagowym. Ponadto, dodatkową zaletą bakteriofagów jest to, że nie atakuj[8]. Istnieją jednak pewne intrygujące doniesienia o interakcji fagów z komórkami eukariotycznymi i z pewnością aspekt ten wymaga wciąż dalszych badań [6, 14].
W trakcie terapii fagowej nie obserwowano dotychczas silnych efektów ubocznych. Obserwowano natomiast występowanie podwyższenia temperatury ciała i pogorszenia samopoczucia pacjentów w związku z uwolnieniem endotoksyn podczas lizy komórek bakteryjnych. Są to jednak efekty uboczne, które często towarzyszą także skutecznej antybiotykoterapii[20].
Terapia fagowa charakteryzuje się również inną, bardzo szczególną cechą. Otóż podobnie jak w przypadku antybiotyków bakterie mogą nabyć oporności przeciwko danemu bakteriofagowi, czy to dzięki mutacjom struktury specyficznych receptorów, czy też dzięki zakodowaniu kluczowych elementów genomu wirusa w systemie odpornościowym bakterii CRISPR (clustered regularly interspaced short palindromic repeats), co skutecznie blokuje jego rozwój w danej bakterii[13]. W podobnej sytuacji gdybyśmy stosowali antybiotyk, musielibyśmy zastosować zupełnie inną substancję, a jest ich generalnie skończona ilość. W przypadku terapii fagowej wystarczy zastosować inny szczep fagowy, o podobnej swoistości względem bakterii ale innym mechanizmie rozpoznawania lub innym genomie. Jest to oczywiście podobne podejście jak wymiana antybiotyku, z tą jednak różnicą, że typów fagów jest ogromie dużo (szacowana ilość bakteriofagów na Ziemi to 1031[4].Dzięki temu znacznie trudniej w czasie terapii jest uzyskać bakteriom oporność na daną kurację fagową, w szczególności gdy stosowane są koktajle fagowe zawierające wirusy specyficznie wiążące się do różnych receptorów (tj. wykorzystujące różne mechanizmy adsorpcji na powierzchni bakterii). Również z tego powodu do prowadzenia efektywnej terapii fagowej bardzo istotne są rozległe kolekcje bakteriofagowe umożliwiające dobór odpowiedniej terapii dla każdego pacjenta.
Za bezpieczeństwem stosowania bakteriofagów przemawia fakt, że są one wszechobecne. System immunologiczny człowieka jest ewolucyjnie przystosowany do ich szybkiego usuwania z organizmu, w szczególności, gdy brak już bakterii umożliwiających im szybkie namnażanie. Ponieważ ludzki organizm na co dzień styka się z bakteriami, z oczywistych względów ma również kontakt z bakteriofagami. Wykazano, że intensywność odpowiedzi immunologicznej na dany szczep fagowy zależy od tego, czy organizm miał z nim wcześniej kontakt (np. przy okazji infekcji bakteryjnej). W takim przypadku nasz organizm jest gotowy do szybkiej odpowiedzi humoralnej na pojawienie się faga [6].Zdolność organizmów kręgowców do szybkiego usuwania bakteriofagów z organizmu jest istotnym utrudnieniem w prowadzeniu skutecznej terapii fagowej i prowadzone są intensywne badania nad wydłużeniem czasu ich krążenia w krwiobiegu poprzez genetyczne modyfikacje białek ich kapsydów.
Ponadto wszechobecność fagów ułatwia również ich pozyskiwanie. Bakteriofagi izoluje się z miejsc naturalnego bytowania ich gospodarzy, czyli bakterii. Z tego właśnie powodu licznie występują one m. in. w wodach Gangesu, których lecznicze właściwości odkrył wspomniany wcześniej bakteriolog, Ernest Hankin.
Najważniejszą zaletą wirusów bakteryjnych jest ich zdolność do namnażania się w organizmie tak długo, jak długo obecne są komórki odpowiedniego gospodarza. Po dotarciu do miejsca zakażenia następuje wykładniczy wzrost liczby cząsteczek bakteriofaga. Dzięki temu nie jest wymagane ich wielokrotne podawanie w celu osiągnięcia pożądanego efektu terapeutycznego [11].
Stosowanie fagów u ludzi
Pierwsze próby zastosowania fagów wleczeniu zakażeń u ludzi zostały podjęte wkrótce po ich odkryciu przez Tworta i d’Hérelle’a. W 1919 roku Felix d’Hérelle zastosował fagi do zwalczania czerwonki u dzieci w L’Hopital des Enfants-malades, pod klinicznym nadzorem ówczesnego szefa pediatrii Victora-Henri Hutinel’a[31]. Wkrótce jego Laboratorium Bakteriofagowe w Instytucie Ludwika Pasteura w Paryżu rozpoczęło produkcję pierwszych komercyjnych koktajli fagowych, które były dostępne we Francji aż do końca lat 70’ XX wieku, kiedy to Instytut Pasteura zaprzestał ostatecznie produkcji preparatów fagowych.
W krajach zachodnich badania nad fagami zostały bardzo mocno zahamowane w rezultacie niezbyt przychylnego artykułu Eatona i Bayne-Jonesa, który został opublikowany w roku 1934 w periodyku Amerykańskiego Towarzystwa Lekarskiego. Sugerował on skuteczność terapii fagowej wyłącznie w bardzo wąskim zakresie, tj. w leczeniu ograniczonych infekcji gronkowcowych i zapalenia pęcherza moczowego
Przedziwnym zrządzeniem losu w roku 1918 do Instytutu Pasteura trafił pierwszy dyrektor gruzińskiego Instytutu Mikrobiologii, Georg Eliava, który stał się bliskim współpracownikiem Felixa d’Herelle’a. To właśnie dzięki współpracy tych dwóch wybitnych mikrobiologów powstała idea, aby Instytut Mikrobiologiczny w Tbilisi przekształcić w światowe centrum badań nad fagami. Projekt uzyskał wsparcie nie tylko ludności gruzińskiej, ale również samego Józefa Stalina i tak narodził się Instytut Bakteriofagów, Mikrobiologii i Wirusologii, jeden z najważniejszych ośrodków terapii fagowych, który funkcjonuje do dziś. Przez cały okres istnienia Związku Radzieckiego Instytut im. Eliavy prowadził intensywne badania naukowe i produkował preparaty fagowe, w dużej mierze na zamówienie radzieckich sił zbrojnych. Istnieje szereg doniesień o skuteczniej terapii fagowej u rosyjskich żołnierzy cierpiących na czerwonkę z okresu zarówno II Wojny Światowej jak i z lat późniejszych [18]. Niestety, wiele z tych doniesień nie jest dobrze udokumentowanych, częściowo ze względu na tajemnicę wojskową. W Instytucie rozwijano terapie przede wszystkim w kierunku leczenia czerwonki i innych biegunek oraz gangreny i zakażeń ropnych. W roku 1980 Instytut zatrudniał aż 1200 pracowników i produkował 2 tony preparatów fagowych rocznie! Jak łatwo się domyślić, po upadku Związku Radzieckiego Instytut stracił swojego głównego odbiorcę (Armię Czerwoną) i musiał poszukiwać innych źródeł finansowania (między innymi, na drodze partnerstwa publiczno-prywatnego oraz wśród zagranicznych agencji badawczo-rozwojowych, np. US Civilian Resarch and Defense Fund).
Do dziś preparaty produkowane przez Instytut (m. in. są dostępne komercyjne w Gruzji i opierają się na pierwotnych formułach opracowanych przez d’Hérelle’a, a przywiezionych do Gruzji przez Georga Eliavę w latach 30. Chociaż różne partie tych koktajli fagowych wykazują zmienną specyficzność względem różnych szczepów, co 6 miesięcy ich działanie jest sprawdzane, a ich skuteczność weryfikowana. W razie obniżenia skuteczności, Instytut suplementuje koktajl dodatkowymi fagami w celu uzyskania zadowalających efektów terapeutycznych. Terapie fagowe są w Gruzji powszechnie znane i stosowane przez lekarzy, a niektóre preparaty można nabyć w aptekach bez recepty.
Początki badań nad fagami w Polsce również poprzedzają odkrycie antybiotyków. Pierwsze wzmianki o wykorzystaniu terapii fagowej na terenie Polski pochodzą z lat dwudziestych[16], ale dopiero powstanie Instytutu Immunologii i Terapii Doświadczalnej Polskiej Akademii Nauk we Wrocławiu z inicjatywy Ludwika Hirszfelda (obecnie patrona Instytutu) w roku 1952 uczyniło nasz kraj jednym z dwóch najważniejszych ośrodków badań nad fagami na świecie. Ośrodek ten od dziesięcioleci rozwija kolekcję wyizolowanych i scharakteryzowanych bakteriofagów o znanej specyficzności[21]. W Instytucie prowadzona jest eksperymentalna terapia fagowa dla pacjentów, u których zawiodły bardziej konwencjonalne, tj. oparte na antybiotykach, metody terapeutyczne. Liczne publikacje autorstwa profesorów Stefana Ślopka i Andrzeja Górskiego (dyrektorów Instytutu) oraz pani dr Beaty Weber-Dąbrowskiej i dr Ryszarda Międzybrodzkiego wykazały, że tak prowadzona terapia fagowa charakteryzuje się wysoką skutecznością. Dzięki terapii fagowej możliwe okazało się wyleczenie zakażeń u chorych, u których wcześniej prowadzono antybiotykoterapię bez dostatecznego efektu lub zastosowanie antybiotyku nie było możliwe z powodu występujących u pacjenta przeciwwskazań do jego podawania. Szczególne znaczenie miało potwierdzenie skuteczności fagoterapii w przypadku infekcji powodowanych przez szczepy oporne na liczne antybiotyki[24].
Świat Zachodni zaczął na powrót odkrywać fagi w latach 80’ XX wieku na skutek publikacji w literaturze anglojęzycznej prac brytyjskich naukowców, Williama Smitha i Michaela B. Hugginsa z Institute for Animal Disease Research[28-29], ale dopiero upadek żelaznej kurtyny i swobodny dostęp do badań polskich i gruzińskich zapoczątkował renesans badań w tej dziedzinie. Drugim czynnikiem, który przyczynił się do intensyfikacji badań nad fagami, był gwałtowny rozwój technik genomicznych, co umożliwiło nie tylko pełniejsze badanie biologii fagów, ale także ich modyfikację czy też wykorzystanie tzw. enzybiotyków, czyli produkowanych przez nie enzymów, w szczególności endolizyn, hydrolizujących peptidoglikan budujący ścianę komórkową bakterii [27]. Białka fagowe, odpowiadające za proces lizy zainfekowanej komórki, już dzisiaj postrzegane są jako potencjalne narzędzie do walki z bakteriami. Intensywne prace nad poznaniem ich działania oraz możliwościami ich genetycznej modyfikacji przybliżają badaczy do chwili, kiedy rekombinowane białka fagowe będą mogły znaleźć zastosowanie lecznicze.
Obecnie wiele ośrodków rozpoczęło intensywne badania nad zastosowaniem fagów w leczeniu chorób zwierząt i ludzi. W ostatnich latach rozpoczęto również szereg badań klinicznych, które mają ostatecznie na celu przebadać bezpieczeństwo i skuteczność terapii fagowej w zwalczaniu zakażeń bakteryjnych oraz umożliwić rejestrację terapii fagowej zgodnie z zachodnimi standardami wypracowanymi dla tradycyjnych leków małocząsteczkowych czy szczepionek. W badaniach klinicznych pierwszej i drugiej fazy oceniono jak dotąd skuteczność i bezpieczeństwo terapii fagowej w leczeniu zakażeń ran oparzeniowych, żylakowych owrzodzeń kończyn dolnych, przewlekłych zapaleń uszu i infekcji zatok przynosowych[1-2, 25, 34].
Zastosowanie fagów w profilaktyce zakażeń
Bakteriofagi mogą być wykorzystywane nie tylko do leczenia infekcji, ale również do zapobiegania zakażeniom. W trzech szpitalach w Tbilisi pobierano próbki bakterii bytujących w salach operacyjnych i na oddziałach intensywnej terapii. Następnie przygotowano preparaty fagowe specyficzne wobec szpitalnych szczepów zakaźnych i przez 6 miesięcy odkażano za ich pomocą powierzchnie szpitalne (ściany, podłogi oraz wyposażenie). Przed rozpoczęciem badania w próbkach pobieranych ze szpitali izolowano szpitalne szczepy t.j. P. aruginosa, Proteu ssp. i Staphylococcu ssp. z częstością odpowiednio 7,2% 11,2% i 13,6%, zaś po 6 miesiącach częstości izolacji wyżej wspomnianych szczepów spadły do 0,3%, 1,8% i 0.9%[18]. Istnieją również doniesienia o zastosowaniu profilaktycznym fagów w warunkach polowych, w szczególności w czasie konfliktów zbrojnych, zarówno przez Armię Radziecką (wieloletnia profilaktyka przeciw-czerwonkowa stosowana w południowych republikach ZSRR), jak i przez armię gruzińską m.in. w czasie konfliktu rosyjsko-gruzińskiego w 2008 roku. Fagi stosowano poprzez spryskiwanie świeżych ran ciekłym preparatem Pyophage oraz poprzez miejscowe stosowanie preparatów fagowych przygotowanych na podstawie wymazów z ran i próbek mikroflory ze szpitali. Chociaż sama terapia fagowa nie okazała się wystarczająca do powstrzymania rozwoju zakażeń, w połączeniu z odpowiednim oczyszczeniem rany doprowadzała do znaczącego skrócenia okresu rekonwalescencji [3, 18].
Znaczenie bakteriofagów w biotechnologii
Bakteriofagi okazały się przydatne nie tylko w zwalczaniu mikroorganizmów. Wyspecjalizowane enzymy bakteriofagów znalazły szerokie zastosowanie w biotechnologii i inżynierii genetycznej [4]. W tym przypadku biotechnologia wykorzystała miliony lat ewolucji, która doskonaliła enzymy fagowe w skuteczniej modyfikacji kwasów nukleinowych. Przecinanie, powielanie, przepisywanie, aktywowanie i sklejanie informacji genetycznej to procesy będące istotą cyklu życiowego bakteriofagów po zainfekowaniu komórki bakteryjnej. Przykładami biokatalizatorów, które znalazły swoje komercyjne zastosowanie w inżynierii genetycznej są enzymy bakteriofaga T4 takie jak ligaza RNA, ligaza DNA, polimeraza DNA i kinaza polinukleotydowa. Ligaza RNA umożliwia łączenie ze sobą dwóch osobnych fragmentów jednoniciowego RNA poprzez syntezę z pomocą ATP wiązania fosfodiestrowego pomiędzy końcem 3’-OH jednej nici i 5′-PO4 drugiej nici RNA[35]. Podobnym enzymem jest ligaza DNA, która katalizuje połączenie zarówno dwuniciowych kawałków DNA, dwuniciowych hybryd DNA/RNA czy nawet jednoniciowych nacięć na dwuniciowym DNA. Enzym ten jest wykorzystywany do wprowadzania fragmentów DNA (tzw. klonowania) do odpowiednich wektorów (tj. kolistych fragmentów DNA). W efekcie możliwe jest produkowanie wybranych przez nas białek przez bakterie (tzw. produkcja białek rekombinowanych). Z kolei polimeraza DNA faga T4 jest wykorzystywany do „stępiania” wystających końców cząsteczek DNA (tzw. aktywność egzonukleazy), gdyż enzymy restrykcyjne (przecinające podwójną nić DNA) zwykle rozcinają ją niesymetrycznie (tzn. w różnych miejscach przecinają obie nici pozostawiając tzw. nawisy). Polimeraza T4 DNA wykorzystywana jest również do znakowania markerami radioaktywnymi lub fluorescencyjnymi fragmentów DNA. Ostatnim ze wspomnianych enzymów fagowych jest kinaza polinukleotydowa, która m.in. katalizuje reakcję transestryfikacji grupy fosforanowej z ATP na wolną grupę 5′ hydroksylową jedno- lub dwuniciowego RNA lub DNA. W biotechnologii enzym ten wykorzystuje się do znakowania nukleotydów przy końcu 5′ DNA za pomocą radioaktywnego fosforanu oraz fosforylowania nukleotydów przy końcu 5′ w DNA i RNA przed wykonaniem ligacji [10]. Enzymy pochodzące z bakteriofaga T4 nie są jedynymi enzymami fagowymi, które znalazły zastosowanie w inżynierii genetycznej – do komercyjnego zastosowania weszło również szereg enzymów bakteriofagów T7, SP6, P3 (m.in. polimerazy RNA, DNA) [8, 30] czy faga λ (egzonukleazy) [36].
Podsumowanie
Od czasu odkrycia bakteriofagów i poznania ich swoistości w rozpoznawaniu bakterii oraz zdolności do lizy komórek bakteryjnych, z powodzeniem próbowano je zastosować w leczeniu zakażeń bakteryjnych. Perspektywa samo replikujących oraz samoregulujących się wirusów, które jako naturalny środek przeciwdrobnoustrojowy mogą przenikać do najgłębszych zakamarków ludzkiego ciała, aby zwalczać wybrane patogeny brzmi niezwykle zachęcająco i przypomina marzenia autorów książek SF marzących o medycznych nano-botach. Terapia przy wykorzystaniu bakteriofagów niesie za sobą wiele korzyści, takich jak zdolność do atakowania i unieszkodliwiania wskazanych patogenów, bez lub przy minimalnym uszczerbku dla zdrowych tkanek oraz mikrobioty zdrowego organizmu. Zaletą bakteriofagów jest także ich umiejętność wnikania w najmniejsze elementy budujące tkanki, krew czy szpik kostny, a następnie całkowita degradacja wirusów po wyeliminowaniu patogenów chorobotwórczych.
Niezależnie od tego, czy zdajemy sobie z tego sprawę czy nie, bakteriofagi bronią nas każdego dnia, ograniczając populacje niezliczonych rzeszy bakterii, które w innym przypadku mogłyby stać się zagrożeniem dla organizmów wyższych. Prócz utrzymywania równowagi w populacjach bakterii zasiedlających różne ekosystemy, fagi mają również wpływ na różnorodność genetyczną mikroorganizmów poprzez proces transdukcji, czyli przeniesienia informacji genetycznej z jednej bakterii do następnej (na skutek błędnego załadowania kapsydu fragmentem DNA bakterii). Fagi w tym procesie pełnią rolę wektora i przyspieszają para-płciową ewolucję bakterii. Tak więc bakteriofagi pełnią bardzo ważną rolę w złożonym ekosystemie naszej biosfery.
Dzięki ich niezwykłym właściwościom przy jednocześnie dość nieskomplikowanej budowie bakteriofagi znajdują zastosowania w coraz to nowych dziedzinach. Naukowcy znajdują czasem zaskakujące i niespodziewane zastosowania dla fagów w biotechnologii i inżynierii genetycznej, do celowanego dostarczania leków, stymulacji układu odpornościowego, terapii genowej, optymalizacji nowych leków peptydowych czy do produkcji biosensorów wykrywające konkretne szczepy bakteryjne. Kto wie, gdzie znajduje się kres możliwości wykorzystania tych fascynujących wirusów?
Podziękowania
A.G. dziękuje za dofinansowanie w ramach projektu InterDokMed numer POWR.03.02.00-00-I013/16.
Literatura:
- Final Report Summary – PHAGOBURN (Evaluation of phage therapy for the treatment of Escherichia coli and Pseudomonas aeruginosa burn wound infections (Phase I-II clinical trial)). https://cordis.europa.eu/result/rcn/208478_en.html.
- AmpliPhi Biosciences Reports Favorable Final Results From Phase 1 Trial of AB-SA01 in Chronic Rhinosinusitis Patients http://investor.ampliphibio.com/press-release/featured/ampliphi-biosciences-reports-favorable-final-results-phase-1-trial-ab-sa01-0.
- Abedon, ST; Kuhl, SJ; Blasdel, BG; Kutter, EM. (2011). Phage treatment of human infections. Bacteriophage 1: 66-85.
- Ashelford, KE; Norris, SJ; Fry, JC; Bailey, MJ; Day, MJ. (2000). Seasonal Population Dynamics and Interactions of Competing Bacteriophages and Their Host in the Rhizosphere. Applied and Environmental Microbiology 66: 4193-4199.
- Cisek, AA; Dąbrowska, I; Gregorczyk, KP; Wyżewski, Z. (2017). Phage Therapy in Bacterial Infections Treatment: One Hundred Years After the Discovery of Bacteriophages. Curr. Microbiol. 74: 277-283.
- Dabrowska, K; Switala-Jelen, K; Opolski, A; Weber-Dabrowska, B; Gorski, A. (2005). Bacteriophage penetration in vertebrates. J Appl Microbiol 98: 7-13.
- Di Bonaventura, I; Jin, X; Visini, R; Probst, D; Javor, S; Gan, B-H; Michaud, G; Natalello, A; Doglia, SM; Kohler, T; van Delden, C; Stocker, A; Darbre, T; Reymond, J-L. (2017). Chemical space guided discovery of antimicrobial bridged bicyclic peptides against Pseudomonas aeruginosa and its biofilms. Chemical Science 8: 6784-6798.
- Doublié, S; Ellenberger, T. (1998). The mechanism of action of T7 DNA polymerase. Curr. Opin. Struct. Biol. 8: 704-712.
- Drulis-Kawa, Z; Majkowska-Skrobek, G; Maciejewska, B. (2015). Bacteriophages and Phage-Derived Proteins – Application Approaches. Current Medicinal Chemistry 22: 1757-1773.
- Eastberg, JH; Pelletier, J; Stoddard, BL. (2004). Recognition of DNA substrates by T4 bacteriophage polynucleotide kinase. Nucleic Acids Res. 32: 653-660.
- Eaton, MD; Bayne-Jones, S. (1934). Bacteriophage therapy: Review of the principles and results of the use of bacteriophage in the treatment of infections. Journal of the American Medical Association 103: 1769-1776.
- Erez, Z; Steinberger-Levy, I; Shamir, M; Doron, S; Stokar-Avihail, A; Peleg, Y; Melamed, S; Leavitt, A; Savidor, A; Albeck, S; Amitai, G; Sorek, R. (2017). Communication between viruses guides lysis-lysogeny decisions. Nature 541: 488-493.
- Fineran, PC; Charpentier, E. (2012). Memory of viral infections by CRISPR-Cas adaptive immune systems: Acquisition of new information. Virology 434: 202-209.
- Gorski, A; Dabrowska, K; Switala-Jeleń, K; Nowaczyk, M; Weber-Dabrowska, B; Boratynski, J; Wietrzyk, J; Opolski, A. (2003). New insights into the possible role of bacteriophages in host defense and disease. Medical Immunology 2: 2.
- Hover, BM; Kim, SH; Katz, M; Charlop-Powers, Z; Owen, JG; Ternei, MA; Maniko, J; Estrela, AB; Molina, H; Park, S; Perlin, DS; Brady, SF. (2018). Culture-independent discovery of the malacidins as calcium-dependent antibiotics with activity against multidrug-resistant Gram-positive pathogens. Nat Microbiol 3: 415-422.
- Kalinowski, W; Czyż, J. (1923 ). Sprawozdanie z epidemii czerwonki w roku 1922. Lek. Wojsk. 4: 286-293.
- Kizziah, J; Manning, K; Dearborn, A; Wall, E; Klenow, L; Hill, R; Spilman, M; Stagg, S; Christie, G; Dokland, T. (2017). Cleavage and Structural Transitions during Maturation of Staphylococcus aureus Bacteriophage 80α and SaPI1 Capsids. Viruses 9: 384.
- Kutter, E; Vos, DD; Gvasalia, G; Alavidze, Z; Gogokhia, L; Kuhl, S; Abedon, ST. (2010). Phage Therapy in Clinical Practice: Treatment of Human Infections. Current Pharmaceutical Biotechnology 11: 69-86.
- Lindberg, AA. (1973). Bacteriophage Receptors. Annual Review of Microbiology 27: 205-241.
- Międzybrodzki, R; Borysowski, J; Fortuna, W; Weber-Dąbrowska, B; Górski, A. (2006). Terapia fagowa jako alternatywa w leczeniu zakażeń wywołanych przez bakterie antybiotykooporne. Kardiochirur. Torakochir. Pol. 3: 201-205.
- Międzybrodzki, R; Borysowski, J; Weber-Dąbrowska, B; Fortuna, W; Letkiewicz, S; Szufnarowski, K; Pawełczyk, Z; Rogóż, P; Kłak, M; Wojtasik, E; Górski, A, Chapter 3 – Clinical Aspects of Phage Therapy. In Advances in Virus Research, Łobocka, M.; Szybalski, W., Eds. Academic Press: 2012; Vol. 83, pp 73-121.
- Okano, A; Isley, NA; Boger, DL. (2017). Peripheral modifications of [Ψ[CH2NH]Tpg4]vancomycin with added synergistic mechanisms of action provide durable and potent antibiotics. Proc. Natl. Acad. Sci. U. S. A. 114: E5052-E5061.
- Pate, JL; Petzold, SJ; Umbreit, TH. (1979). Two flagellotropic phages and one pilus-specific phage active against Asticcacaulis biprosthecum. Virology 94: 24-37.
- Rakhuba, DV; Kolomiets, EI; Dey, ES; Novik, GI. (2010). Bacteriophage receptors, mechanisms of phage adsorption and penetration into host cell. Pol J Microbiol 59: 145-55.
- Rhoads, DD; Wolcott, RD; Kuskowski, MA; Wolcott, BM; Ward, LS; Sulakvelidze, A. (2009). Bacteriophage therapy of venous leg ulcers in humans: results of a phase I safety trial. Journal of Wound Care 18: 237-243.
- Schlegel, HG, Wirusy bakteryjne (bakteriofagi). In Mikrobiologia ogólna, 2 ed.; Wydawnictwo Naukowe PWN: Warszawa, 2003; pp 181-200.
- Schmelcher, M; Donovan, DM; Loessner, MJ. (2012). Bacteriophage endolysins as novel antimicrobials. Future microbiology 7: 1147-1171.
- Smith, HW; Huggins, MB; Shaw, KM. (1987). Factors influencing the survival and multiplication of bacteriophages in calves and in their environment. J Gen Microbiol 133: 1127-35.
- Smith, HW; Huggins, MB; Shaw, KM. (1987). The control of experimental Escherichia coli diarrhoea in calves by means of bacteriophages. J Gen Microbiol 133: 1111-26.
- Sousa, R; Mukherjee, S, T7 RNA Polymerase. In Prog. Nucleic Acid Res. Mol. Biol., Academic Press: 2003; Vol. 73, pp 1-41.
- Summers, WC, Felix d’Herelle and the Origins of Molecular Biology. Yale University Press:: New Haven, Connecticut, USA, 1999.
- van den Worm, SHE; Valegård, K; Fridborg, K; Liljas, L; Stonehouse, NJ; Murray, JB; Walton, C; Stockley, PG. (1998). Crystal structures of MS2 coat protein mutants in complex with wild-type RNA operator fragments. Nucleic Acids Research 26: 1345-1351.
- Weinbauer, MG. (2004). Ecology of prokaryotic viruses. FEMS Microbiology Reviews 28: 127-181.
- Wright, A; Hawkins, CH; Anggard, EE; Harper, DR. (2009). A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistant Pseudomonas aeruginosa; a preliminary report of efficacy. Clin Otolaryngol 34: 349-57.
- Yin, S; Kiong Ho, C; Miller, ES; Shuman, S. (2004). Characterization of bacteriophage KVP40 and T4 RNA ligase 2. Virology 319: 141-151.
- Zhang, J; McCabe, KA; Bell, CE. (2011). Crystal structures of λ exonuclease in complex with DNA suggest an electrostatic ratchet mechanism for processivity. Proc. Natl. Acad. Sci. U. S. A. 108: 11872-11877.