Od benzyny do hiacynta – enzym zmienia zapachy
Maciej Szaleniec
Instytut Katalizy i Fizykochemii Powierzchni im. Jerzego Habera Polskiej Akademii Nauk, ul. Niezapominajek 8, 30-239 Kraków
Od blisko dwóch stuleci uczeni i technologowie poszukują coraz lepszych i tańszych metod syntezy, doskonaląc katalizatory – związki, przyspieszające i zwiększające wydajność procesów chemicznych. Tymczasem przez miliony lat w organizmach żywych na drodze ewolucji Natura wytworzyła niesłychanie wyspecjalizowane katalizatory – enzymy.
Synteza chemiczna to największa dziedzina przemysłu w Europie. Według Naukowo-Technologicznej Mapy Drogowej Katalizy przygotowanej przez European Resaerch Institute of Catalysis więcej niż 85% produktów powstaje przy udziale katalizy. Dzięki katalizie powstaje lepsze i tańsze paliwo, liczne tworzywa sztuczne, środki czystości i leki. Katalizatory stosowane są w ochronie środowiska, np. dopalając spaliny w każdym samochodzie czy usuwając zanieczyszczenia z wody. Zastosowanie katalizy wychodzi również poza przemysł chemiczny znajdując swoje zastosowane w energetyce, np. w ogniwach paliwowych, bateriach czy przy produkcji bio-paliw.
Katalizator – jak to działa?
Jak katalizator obniża koszty produkcji przemysłowej? Po pierwsze – przyspiesza reakcję chemiczną. Produkując dany związek, chcemy, aby powstawał w dużych ilościach i możliwie szybko. Dla przyspieszenia reakcji proces najczęściej prowadzi się w podwyższonej temperaturze. Gdy podwyższamy temperaturę chemiczne cząsteczki szybciej się poruszają, mają więcej energii, gdy dochodzi do ich zderzeń, co ułatwia przemiany chemiczne. Zamiast podgrzewać reaktor, co wymaga energii i oczywiście generuje sporo CO2, można zastosować katalizator, który pozwala zachodzić reakcji z dużą szybkością w niższej temperaturze. Po drugie – dzięki katalizatorowi pewna „ścieżka reakcji” staje się bardziej uprzywilejowana. Dzięki temu powstaje tylko jeden, żądany związek, co pozwala uniknąć wytwarzania odpadów chemicznych. Chemicy nazywają to zjawisko selektywnością procesu katalitycznego – to tak jakby katalizator dokonywał selekcji tylko jednej z możliwych dróg przemian chemicznych i tylko tę właśnie przyspieszał. Pozostałe drogi są wolniejsze i dlatego cząsteczki w bardzo niewielkim stopniu nimi podążają. W efekcie proces katalizowany jest znacznie tańszy, a dzięki oszczędności energii i minimalizacji produkcji odpadów, również bardziej ekologiczny.
Idealny katalizator powinien pracować w temperaturze otoczenia, w nietoksycznym środowisku i prowadzić do powstania tylko jednego, żądanego produktu. Niestety taki katalizator bardzo trudno otrzymać metodami chemicznymi. Na szczęście Natura wykonała sporą część pracy za nas – dzięki miliardom lat ewolucji wyposażyła organizmy żywe w enzymy, które spełniają wszystkie te warunki i katalizują miliony reakcji chemicznych.
Biokatalizatory to niezwykle skomplikowane cząsteczki biologicznych polimerów. Większość z nich to białkowe enzymy (składające się z połączonych aminokwasów), chociaż znane są też biokatalizatory, w których główną komponentą są kwasy nukleinowe (tzw. rybozymy). Nić biopolimeru, układając się w skomplikowany wzór, tworzy stabilny szkielet, otaczający centrum aktywne, w którym zachodzi reakcja katalityczna. Enzym jest bardzo wydajnym i wybiórczym katalizatorem – pracuje zazwyczaj w temperaturze pokojowej, w środowisku wodnym i prowadzi syntezę zwykle tylko do jednego produktu. Niestety wciąż nie potrafimy sami wymyślić jak zsyntetyzować enzymy z poszczególnych aminokwasów, aby uzyskać efektywne katalizatory. Chociaż na tym polu czynimy wciąż postępy, wciąż nie jesteśmy wstanie doścignąć Natury. Również, jeśli chodzi o pozyskiwanie białek bazujemy na ich naturalnych źródłach. Z przyczyn etycznych staramy się unikać izolacji enzymów z wyższych zwierząt. Dlatego najbardziej efektywnym sposobem pozyskiwania enzymów jest obecnie wykorzystanie mikroorganizmów. W tym celu wykorzystuje się organizmy naturalne (to znaczy niezmodyfikowane genetycznie, choćby takie jak drożdże piekarskie) jak i genetycznie zmodyfikowane. Aby zaprząc bakterie do produkcji potrzebnego enzymu wszczepia się jej kod DNA z instrukcją syntezy danego enzymu, a następnie, po namnożeniu kolonii bakteryjnej, wzbudza się biosyntezę. W rezultacie bakterie produkują gotowy enzym, który następnie można oczyścić i używać do prowadzenia wybranej reakcji albo nawet zastosować w procesie całe bakterie (jak małe kapsułki wypełnione katalizatorem). To właśnie takie rekombinowane enzymy znajdziemy nie tylko w przemysłowych reaktorach, ale w naszych płynach do prania (gdzie proteazy i lipazy usuwają plamy z białka i tłuszczy) czy kuchniach (do produkcji domowych serów czy zmiękczania mięsiwa).
Z dna Wezery do laboratorium
W Instytucie Katalizy i Fizykochemii Powierzchni PAN od wielu lat badamy m.in. dość nietypowy enzym – dehydrogenazę etylobenzenową. Pochodzi on z bakterii Aromatoleum aromaticum, odkrytej w osadach dennych Wezery, niedaleko Bremy w Niemczech. Bakterie te żyje w środowisku beztlenowym, wykorzystując jako pożywkę substancje, będące truciznami dla większości organizmów żywych, toluen, etylobenzen czy propylobenzen, i oddychają rozpuszczonymi w wodzie azotanami zamiast tlenem. Dehydrogenaza etylobenzenowa katalizuje reakcję utlenienia etylobenzenu do (S)-1-fenyloetanolu. Na czym polega niezwykłość katalizowanej przez nią reakcji? Po pierwsze, – co dość oczywiste w warunkach beztlenowych enzym nie może korzystać w reakcji utlenienia z cząsteczki tlenu, jak to ma miejsce w większości organizmów zdolnych do utleniania węglowodorów. Zamiast tego wykorzystuje znajdujący się w centrum aktywnym specjalny kofaktor molibdenowy, który pozyskuje tlen z wody. Po oddzieleniu dwóch protonów od wody ligand tlenowy metalu (tak zwany ligand okso) nadaje się do utleniania organicznego substrat. Drugą, bardzo cenną z przemysłowego punktu widzenia cechą jest fakt, że produktem reakcji jest tylko jeden izomer optyczny o konfiguracji S.
Związki, będące izomerami optycznymi, mają identyczne właściwości fizykochemiczne poza tym, że zmieniają polaryzację przechodzącego przez nie światła w odwrotnych kierunkach. Drobna różnica? Otóż nie – gdy chodzi o działanie biologiczne, izomeria optyczna jest szalenie istotna. Wszystkie aminokwasy budujące organizmy żywe są zbudowane z jednego tylko typu izomerów optycznych (tzw. enancjomerów) i większość ziemskich organizmów nie jest w stanie wykorzystywać do biosyntezy aminokwasów o innej konfiguracji. Również nasze zmysły powonienia i smaku doskonale radzą sobie z rozróżnianiem enancjomerów. Wykorzystywany w przemyśle spożywczym, jako środek zapachowy (S)-1-fenyloetanol pachnie delikatnie hiacyntem z wyczuwalną nutką gardenii i truskawek, podczas gdy jego lustrzane odbicie, (R)-1-fenyloetanol, wydziela zapach miodowo-kwiatowy, zaś w smaku przypomina niedojrzałe owoce.
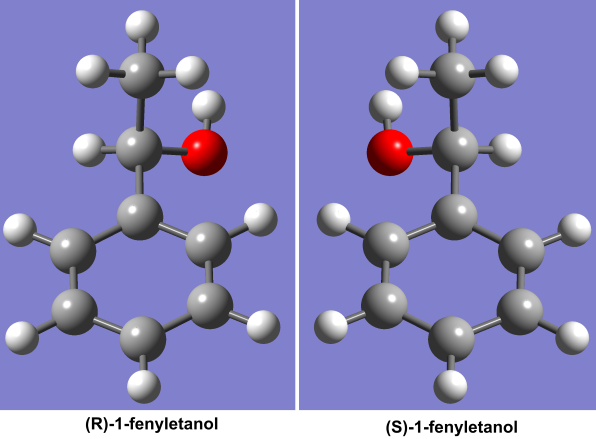
Enancjomery – cząsteczki, które różnią się tylko tym, że są swoimi lustrzanymi odbiciami, miewają zaskakująco odmienne właściwości.
Różne izomery optyczne mogą oddziaływać odmiennie nie tylko na zmysł powonienia, ale też na nasze zdrowie. Często jeden izomer optyczny ma działanie terapeutyczne, a drugi może wywoływać niepożądane skutki uboczne. Stąd wielkie zainteresowanie przemysłu farmaceutycznego związkami o wysokiej optycznej czystości, które mogą być wykorzystane do syntezy nowych leków.
Odkryliśmy, że dehydrogenaza etylobenzenowa jest bardzo wszechstronnym enzymem. Potrafi bowiem katalizować reakcję utlenienia wielu związków o podobnej do etylobenzenu strukturze. W każdym przypadku powstaje alkohol – w analogiczny sposób jak przy syntezie 1-fenyloetanolu.
Dzięki temu odkryciu uzyskaliśmy od natury narzędzie, zdolne do wytwarzania ponad 30 nowych alkoholi [1], które mogą posłużyć nie tylko jako zapachy do perfum i kremów, ale przede wszystkim jako cegiełki do budowy nowych leków. Sprawdziliśmy bowiem stosując specjalną chromatografię chiralną (czyli taką, która rozpoznaje enancjomery), że podobnie jak w przypadku utleniania etylobenzenu, tak i dla pozostałych substratów enzym wykazuje wysoką selektywność reakcji – to znaczy powstaje tylko jeden izomer optyczny alkoholu.
W jaki sposób dehydrogenaza etylobenzenowa prowadzi tę niezwykłą reakcję? Aby rozwikłać tę intrygującą zagadkę, zastosowaliśmy modelowanie molekularne. Dzięki złożonym obliczeniom, które wymagały zastosowania superkomputerów z Akademickiego Centrum Komputerowego CYFRONET, udało się odkryć, że okso ligand odrywa atom wodoru od węglowodoru (Rys. 1) a następnie od centrum molibdenowego oddziela się grupa OH i przyłącza się do substratu, tworząc alkohol. Enzym zaś ma specjalnie wykrojone centrum aktywne w kształt, który pozwala substratowi ustawić się tylko w jeden sposób w kierunku molibdenowego centrum [2]. To właśnie dzięki temu enzym jest wysoce selektywny, gdyż utlenianie zachodzi tylko z jeden strony cząsteczki. Taka wiedza okazała się zresztą znacznie cenniejsza niż sama umiejętność przemiany odoru stacji benzynowej w delikatną woń hiacyntów, – bo dehydrogenaza etylobenzenowa okazała się pierwszym enzymem z całej grupy bardzo ciekawej katalizatorów molibdenowych. Jeden z nich być może będzie wkrótce produkował cenne dla nas leki.
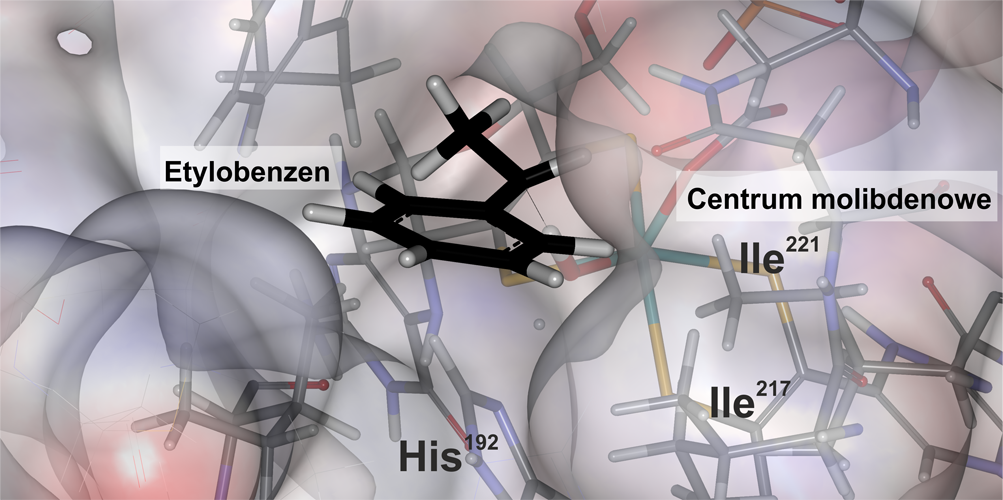
Rys. 1. Ligand okso kofaktora molibdenowego aktywuje etylobenzen [2].
Literatura
[1] M. Szaleniec, C. Hagel, M. Menke, P. Nowak, M. Witko, J. Heider, “Kinetics and mechanism of oxygen-independent hydrocarbon-hydroxylation by ethylbenzene dehydrogenase”, Biochemistry 2007; 46, 7637-7646
[2] M. Szaleniec, A. Dudzik, B. Kozik, T. Borowski, J. Heider, M. Witko, “Mechanistic basis for the Enantioselectivity of the Anaerobic Hydroxylation of Alkylaromatic compounds by Ethylbenzene Dehydrogenase”, J. Inorg. Biochem., 139 (2014) 9-20