Nieoczekiwane odkrycie – nowa wolframowa hydrogenaza
Maciej Szaleniec,
Instytut Katalizy i Fizykochemii Powierzchni im. Jerzego Habera Polskiej Akademii Nauk
Kilka lat temu napisałem grant do European Research Council, starając się uzyskać od tej najbardziej cenionej w Europie instytucji finansowanie na badania. Chciałem badać enzym pochodzący z bakterii żyjącej w pobliżu wulkanicznych kominów, który zawiera w swoim wnętrzu atom wolframu. Ku mojej rozpaczy wniosek grantowy został zdruzgotany krytyczną recenzją. Ekspert ocenił, że w proponowanym temacie nie powstało przez ostatnie 25 lat żadne odkrycie, więc nie sądzi, aby finansowanie moich badań miało jakikolwiek sens. Kilka lat później okazało się, jak bardzo ów ekspert się pomylił…
Wodór – nie tylko paliwo przyszłości
Wszyscy wiążemy wiele nadziei z alternatywnym paliwem, jakim jest wodór. Zmiany klimatu i zatrucie środowiska, jakie wynika ze spalania paliw kopalnych, prędzej czy później wymusi zmiany na naszej cywilizacji. Tymczasem wodór jest czystym paliwem, bo w czasie jego spalania powstaje tylko woda. Co więcej jest go wokół nas bardzo dużo – jest co prawda uwięziony w wodzie, ale mamy go w ogromnych ilościach – pokrywa 70% powierzchni naszej planety. Umiemy go też dość łatwo z tej wody uwolnić za pomocą elektrolizy, która może być zasilana prądem z baterii słonecznych.Wodór jest nie tylko cennym paliwem. Jest również bardzo wartościową substancją dla chemii przyszłości, szczególnie gdy zrezygnujemy z przetwarzania ropy naftowej. Od ponad 150 lat większość naszego przemysłu chemicznego wykorzystuje ropę do produkcji substancji chemicznych, plastików, rozpuszczalników, środków czystości czy leków. W przyszłości musimy to zmienić, gdyż zasoby ropy nie są niewyczerpane. Już dziś chemicy i biotechnolodzy pracują nad tym, by wykorzystać substancje chemiczne znajdujące się przede wszystkim w roślinach tak, abyśmy mogli zastąpić ropę naftową np. celulozą czy ligniną z masy drzewnej (albo innej biomasy roślinnej,(w szczególności odpadowej). Dodatkowym plusem takiej zmiany jest to, że drzewa wytwarzają drewno wykorzystując dwutlenek węgla z atmosfery, a więc przeciwdziałają ocieplaniu klimatu. Z substancjami chemicznymi pochodzącymi z drewna jest jednak kilka problemów. Otóż zawierają one zbyt wiele atomów tlenu, abyśmy mogli zastosować je na przykład jako paliwa. Weźmy choćby główny składnik drewna – celulozę, która jest cukrem – zwanym również węglowodanem, co oznacza, że na każdy atom węgla przypada jeden atom tlenu i dwa wodoru – tak jak w wodzie (H2O). Tymczasem nasz przemysł chemiczny przyzwyczaił się do przeróbki węglowodorów – czyli związków zawierających głównie atomy węgla i wodoru. Czy istnieje jakiś sposób, aby połączyć nowe odnawialne źródła związków chemicznych pochodzących z natury z naszym obecnym przemysłem? Okazuje się, że jest to możliwe! Można „zredukować” zawartość tlenu w tych substancjach, czyli usunąć z nich tlen i chemicznie przemienić je w związki bardziej przypominające te pochodne z ropy naftowej. Jedną z takich ekologicznych sposobów na przeprowadzenie redukcji jest potraktowanie tych związków wodorem, który w przyszłości również będziemy pozyskiwać metodami ekologicznymi. Aby jednak efektywnie prowadzić procesy redukcji wodorem, potrzebne są katalizatory, które przyspieszają reakcje chemiczne i jeszcze pozwalają nam przekształcać substancje chemicznie zgodnie z naszym życzeniem. I chociaż badania nad katalitycznym uwodornieniem trwają od lat i mamy już kilka przemysłowych katalizatorów, wciąż na tym polu jest sporo do odkrycia, szczególnie w bio-katalizie.
Wolframowa oksydoreduktaza z bakterii beztlenowych
I tutaj właśnie wracamy do mojego tytułowego „nieoczekiwanego odkrycia”. Pomimo braku prestiżowego grantu z ERC udało nam się uzyskać niewielki grant z Narodowego Centrum Nauki dla mojej doktorantki, Agnieszki Winiarskiej. Razem z moimi współpracownikami z Niemiec zaczęliśmy badać wolframową oksydoreduktazę aldehydów, która pochodziła z bakterii Aromatoleum aromaticum1. Jak sama nazwa bakterii wskazuje jest to organizm, który potrafi żywić się aromatycznymi węglowodorami.
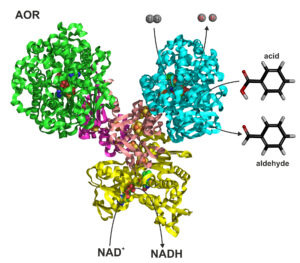
Rys. 1. Wolframowa oksydoreduktaza aldehydów. Atomy wolframu znajdują się w katalitycznych podjednostkach zaznaczonych kolorem zielonym i niebieskim.
Wolframowa oksydoreduktaza (Rys. 1) jest używana przez bakterie do utleniania aldehydów do kwasów karboksylowych. Aldehydy są substancjami toksycznymi – to właśnie po nich boli nas głowa po zakrapianej imprezie. Gdy nasze enzymy metabolizują alkohol etylowy przemieniając go w aldehyd octowy, zatruwa on organizm powodując nieprzyjemne objawy kaca. Również bakterie, „spożywając” i przetwarzając różne substancje chemiczne, czasami wyprodukują toksyczne aldehydy, których chcą się szybko pozbyć. Jak się okazało w trakcie naszych badań do tego właśnie służy badany przez nasz enzym – odtruwa komórki bakteryjne utleniając aldehydy do znacznie bardziej bezpiecznych kwasów. Co ciekawe, radzi sobie z tym bez użycia tlenu cząsteczkowego, a więc przyspiesza reakcje w zupełnie inny sposób, niż robią to enzymy w organizmach oddychających tlenem. Z enzymami beztlenowymi pracujemy w komorach beztlenowych – to takie wielkie pudła wyposażone w gumowe rękawice pozwalające naukowcom na manipulowanie przedmiotami w przestrzeni, gdzie znajduje się gaz pozbawiony tlenu (Rys. 2). Zarówno w moim laboratorium, jak i u moich niemieckich współpracowników wykorzystujemy ten sam typ komór – wypełnione są one głównie neutralnym azotem z odrobiną wodoru. Ponieważ komory nie są zupełnie szczelne, do środka wkładamy specjalny katalizator, który za pomocą wodoru redukuje resztki tlenu zamieniając go w wodę. W czasie pobytu w Marburgu moja doktorantka badała enzym właśnie w takiej komorze – jej głównym zadaniem byłosprawdzanie, jak szybko utlenia on różne aldehydy do kwasów organicznych. Aby zaobserwować taką reakcję wykorzystujemy spektrofotometry, urządzenia, które są w stanie rozpoznać zmianę koloru cieczy. Po powrocie do Krakowa moja doktorantka kontynuowała badania w naszej komorze. Ze zdziwieniem zaobserwowała, że roztwór zawierający enzym zaczyna zmieniać kolor, zanim jeszcze doda aldehyd, który miałby zostać utleniony. Reakcja wydawała się zachodzić sama, w jakiś niesamowity alchemiczny sposób. Czegoś takiego nigdy nie zaobserwowała w czasie pobytu badawczego w Niemczech! Oczywiście okazało się, że to jednak nie magia – w komorze unosił się bowiem, oprócz niereaktywnego azotu, jeszcze gaz, którego nikt nie podejrzewał – wodór. Gazy rozpuszczają się w cieczy, więc wodór miał kontakt z enzymem, enzym utleniał wodór, a następnie reagował z barwnikiem w cieczy, co powodowało zmianę jej koloru. I w ten trochę przypadkowy sposób odkryliśmy nową hydrogenazę!2

Rys. 2. Praca z enzymami beztlenowymi wymaga specjalnej komory rękawicowej, wypełnionej atmosferą pozbawioną tlenu. W naszym urządzeniu jest to azot z niewielką domieszką wodoru.
Hydrogenazy – enzymy z wodorem za pan brat
Hydrogenazy to metaloenzymy, zdolne zarówno utleniać wodór – a więc rozdzielać znajdujące się w jego cząsteczkach protony od elektronów, jak i z tych protonów obecnych w roztworze i elektronów na powrót zsyntezować cząsteczkę wodoru3. Dotąd znane były wyłącznie hydrogenazy zawierające w swoim katalitycznym sercu jeden lub dwa atomy żelaza albo atomy niklu i żelaza. Jak dotąd nikt nie odkrył enzymu katalizującego taką reakcję dzięki atomowi wolframu. Aktywność hydrogenazy jest niezwykle atrakcyjna dla przemysłu biotechnologicznego. Pozwala uwolnić elektrony zawarte w cząsteczce wodoru i zredukować inne substancje chemiczne. W naszym przypadku zastosowanie wodoru umożliwia odwrócenie naturalnej reakcji – czyli z kwasów karboksylowych można zrobić aldehydy. Dlaczego jednak ktoś chciałby produkować toksyczne aldehydy? Po pierwsze nie wszystkie aldehydy są toksyczne. Wiele z nich ma bardzo przyjemny zapach i są niezwykle cennymi dodatkami do żywności i perfum. Dobrym przykładem jest tutaj substancja odpowiedzialna za bardzo przyjemny zapach wanilii – aldehyd wanilinowy. Nasz enzym umożliwia jego4 otrzymywanie z kwasu wanilinowego. Reaktywne aldehydy są również bardzo użytecznymi substancjami wyjściowymi do wielu innych ciekawych reakcji – można z nich wytwarzać alkohole, aminy i inne przydatne substancje, w tym komponenty do leków. I tutaj wracamy do nowych źródeł substancji chemicznych, które nie pochodzą z ropy naftowej. Drewno składa się z dwóch podstawowych składników – celulozy i ligniny. Oba z nich po przetworzeniu możemy zamienić w kwasy organiczne, które właśnie za pomocą naszego enzymu oraz czystego wodoru możemy przetwarzać w wartościowe produkty takie jak leki, środki ochrony roślin, rozpuszczalniki czy komponenty do polimerów.
Nie tylko aldehydy – czyli jak podłączyć enzym do prądu
Czy to wszystko do czego możemy wykorzystać wolframową oksydoreduktazę aldehydów? Otóż nie! W bakterii po utlenieniu aldehydów enzym redukuje specjalną cząsteczkę – NAD. Jest ona wykorzystywana do przenoszenia „zdolności redukcji” w organizmie. Wiele innych enzymów wykorzystuje jej zredukowaną postać do zasilania swoich reakcji redukcji. Tak więc możliwe jest wykorzystanie NADH do syntezy alkoholi, amin czy innych cząsteczek zupełnie bez odpadów – cały „wodór” trafia bowiem do ostatecznego produktu. Nasi współpracownicy z Marburga poszli jeszcze dalej4 . Podłączyli nasz enzym do elektrody i dodali jeszcze kilka biokatalizatorów. Po zredukowaniu enzymu prądem elektrycznym możliwe było wyprodukowanie cząsteczki ATP, która jest uniwersalnym paliwem komórek żywych. A to otwiera szereg kolejnych zastosowań biotechnologicznych i może bezpośrednio połączyć zieloną energię elektryczną z biotechnologicznym wytwarzaniem substancji chemicznych. Tak więc perspektywy zastosowania enzymu wydają się bardzo szerokie.
Fortunna awaria
Na koniec – pewnie zastanawialiście się, dlaczego moi koledzy z Niemiec nie wykryli tej zaskakującej właściwości oksydoreduktazy w swojej komorze beztlenowej. Otóż przyczyna okazała się niezwykle trywialna. W ich instalacji zepsuł się czujnik wodoru – pokazywał, że jest go kilka procent, gdy tymczasem było go znacznie mniej (Rys. 3). Tak więc nie było możliwości wykrycia nietypowej aktywności enzymu, bo zawartość rozpuszczonego wodoru w cieczy była zbyt mała. W naszej instalacji wszystko działało i było tego wodoru w sam raz, aby dokonać odkrycia na terenie Polski. Odrobina szczęścia zawsze się przydaje, nie tylko w codziennym życiu, ale i w nauce.
Literatura
1. Rabus, R.; Kube, M.; Heider, J.; Beck, A.; Heitmann, K.; Widdel, F.; Reinhardt, R., The genomesequence of an anaerobic aromatic-degrading denitrifying bacterium, strain EbN1. Arch. Microbiol.2005, 183 (1), 27-36.
2. Winiarska, A.; Hege, D.; Gemmecker, Y.; Kryściak-Czerwenka, J.; Seubert, A.; Heider, J.;Szaleniec, M., Tungsten Enzyme Using Hydrogen as an Electron Donor to Reduce Carboxylic Acids and NAD+. ACS Catalysis 2022, 12 (14), 8707-8717.
3. Lubitz, W.; Ogata, H.; Rüdiger, O.; Reijerse, E., Hydrogenases. Chem. Rev. 2014, 114 (8), 4081-4148.
4. Luo, S.; Adam, D.; Giaveri, S.; Barthel, S.; Cestellos-Blanco, S.; Hege, D.; Paczia, N.; Castañeda-Losada, L.; Klose, M.; Arndt, F.; Heider, J.; Erb, T. J., ATP production from electricity with a new-to-nature electrobiological module. Joule 2023, 7 (8), 1745-1758